連続血圧計測を実現するセンサ技術
オムロン ヘルスケア株式会社では、一拍毎に変動する血圧を連続して計測する技術の開発に取り組んでいる。一拍毎の連続血圧計測技術の実現によって、従来のオシロメトリック法による血圧計測では捉えることのできないリスクの高い血圧変動を検出し、脳・心血管疾患の発症リスクを事前に予測できることが期待されている。一拍毎の非侵襲血圧計測を可能とするトノメトリ法においては、圧力センサを皮膚に直接押圧する。したがって、圧力センサを樹脂封止する必要が生じるが、樹脂応力によってセンサ特性や実装歩留まりが悪化し、耐久性にも課題があった。筆者らは、46個もの圧力センサエレメントを有するASIC混載のMEMS圧力センサを開発し、樹脂封止しても全エレメントが高精度の圧力センサとして特性を担保できる、また実装歩留まりや耐久性を抜本的に改善する新しいパッケージ構造とその工法を開発することに成功した。
1. 序論
血圧は、病院だけでなく家庭でも計測することで高血圧の治療や管理、また予防に役立てる文化が現在では広く定着してきた。家庭での血圧計測の普及の背景には、使用者が血圧計測に関する特別な知識や手技が必要とならないオシロメトリック法の開発 1) 2)、大迫研究を代表とした家庭で計測する血圧の重要性を示す研究が進められてきたこと 3)、また機器の自動化や小型化、ユーザビリティの改善といった血圧計測器としての進歩などがある。
一方で、家庭血圧計が普及して高血圧診療が発展してきた現在においても、十分な降圧治療が行われていない症例も未だあることが知られている 4)。オシロメトリック法では、上腕あるいは手首にカフを巻いて圧迫し、一度血流を遮断することで血圧を計測するため、一回の測定に数十秒の時間を要する。しかしながら、実際には血圧は一拍毎に変動するため、オシロメトリック法で捉えることが出来ていない脳・心血管疾患の発症リスクの高い血圧変動があると考えられる。そこで、オムロン ヘルスケア株式会社では、一拍毎の血圧を連続して計測する機器の開発に取り組んでおり、現在の高血圧診療への更なる貢献を試みている 5)。
非侵襲的に一拍毎で血圧を連続計測する機器として、トノメトリ法を利用したJENTOW 6)と呼ばれる商品がある。トノメトリ法とは、圧力センサを皮膚に直接押圧することで圧脈波を計測し、圧脈波から血圧を算出する手法である。
JENTOWは大型の据置型の機器であったが、現在オムロン ヘルスケア株式会社で開発している連続血圧計測技術は手首装着型の機器を目指しており、計測可能な環境の拡大、ユーザビリティの改善、測定安定性の向上などに取り組んでいる。
本論文では、オムロン ヘルスケア株式会社が保有する血圧計測のノウハウと、オムロン株式会社が保有するセンサ開発技術を基盤に、連続血圧計測技術を実現するために新規で開発したMEMS圧力センサと、そのパッケージ構造および工法について述べる。
2. 連続血圧計測技術とセンサ技術
2.1 トノメトリ法
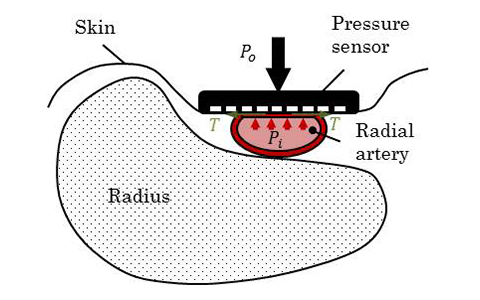
トノメトリ法の概要を図1に示す。上腕や手首に装着したカフで血管を圧迫するオシロメトリック法と異なり、トノメトリ法では皮膚に直接圧力センサを押圧することで圧脈波を計測し血圧を算出する。圧力センサを動脈上の皮膚から押圧すると、押圧面における力学的平衡は、ラプラスの法則に血管壁の厚みを考慮した式で表すことができる 7)。
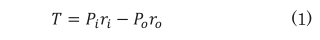
Tは血管壁における周方向の張力、Pi は血圧、Po は外圧、ri および ro はそれぞれ血管内壁および血管外壁のセンサ押圧面での曲率半径である。また、式(1)は式(2)のように変形できる。
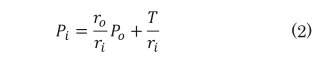
図1に示すように、センサ押圧面において血管が扁平に潰れていれば、となり、式(2)は式(3)のように近似できる。

すなわち、血管を最適な押圧力で圧扁できれば、押圧力すなわち圧力センサで検出される圧力と血圧が同等となる。したがって、圧力センサを最適な押圧力で保持し続ければ、血流を遮断することなく連続して血圧を計測することが可能であり、血管にカテーテルを挿入して計測する血圧波形と同等の圧脈波波形が計測できる。また、式(3)の条件が最も成立するのは血管直上に圧力検出素子が位置する場合である。したがって、トノメトリ法を用いる場合には、複数の圧力検出素子を有する圧力センサを採用することで、血管位置と押圧位置の関係を正しく知る必要がある。
2.2 センサ技術への要求事項
2.1節の通り、トノメトリ法では圧力センサを皮膚に直接押圧するという特徴から、オシロメトリック法による血圧計測とはセンサへの要求事項が根本的に異なる。
第一の要求として、圧力センサの数である。トノメトリ法では圧力センサを皮膚に直接押圧し、血管と圧力センサの位置を正しく把握して、血管中心直上の皮膚表面に伝達する圧脈波を検出する必要がある。したがって、手首の橈骨動脈の場合、数100 µmピッチで圧力センサエレメントを数十個並べる必要がある。また、オシロメトリック法を採用した血圧計ではカフ内圧を計測する圧力センサ一つの精度を担保すればよいが、トノメトリ法では狭ピッチで並べられた複数の圧力センサ全ての精度を保証できることが要求される。
第二の要求として、特殊なパッケージである。オシロメトリック法に用いられるセンサは主に半導体プロセスによって作製された圧力センサ(MEMS圧力センサ)で、空気を圧力伝達の媒体としてカフ内の圧力を計測している。一方で、トノメトリ法においてはMEMS圧力センサを皮膚に直接押圧するために、半導体のセンサチップを生体適合性の良い樹脂などで保護する必要があり、圧力を伝達する物質は空気ではなくその樹脂である。一般的な抵抗式半導体圧力センサでは、圧力によるセンサ部の機械的な変形を半導体ひずみゲージにより検出して電気信号に変換するため、検出すべき圧力以外の力がセンサに加わると全て誤差となる。そのため、パッケージングにおいてはセンサチップに応力を加える、あるいは応力を残留させる可能性のあるものはできる限り排除して実装する。しかしながら、トノメトリ法では、あえて特性を悪化させる可能性のある樹脂を圧力センサ表面に塗布する必要があるという、特殊なパッケージング技術が要求される。
2.3 従来機器における課題
従来のトノメトリ法による圧脈波あるいは血圧測定機器における課題をセンサ、センサの実装、システム全体の観点で大別して表1に示す。
| No. | 分類 | 課題 |
|---|---|---|
| 1 | センサ | 電極数が多く実装歩留まりが悪化する 雑音耐性が低い |
| 2 | センサ実装 | 樹脂塗布によりセンサ特性が悪化する. 樹脂塗布により歩留まりが悪化する. |
| 3 | システム | 機器が大型で計測環境が限定される. |
従来のマルチエレメントMEMS圧力センサは、ダイアフラム上にピエゾ抵抗素子が複数形成された単純な構成となっており、形成したエレメント数に応じた電極が必要となることから、工程においても電極数が多いことで実装歩留まりが悪化する原因となっていた。また、ピエゾ抵抗素子から直接配線を後段の回路基板まで引き出す必要があったため、センサ特性や雑音耐性の悪化などの原因となっていた。
また、実装面の観点では、圧力センサ表面に樹脂を塗布する必要があることから、樹脂の温度による膨張収縮、あるいは硬化時に樹脂が収縮を生じることでセンサに応力が加わり、センサの特性や実装歩留まりが悪化する課題があった。
さらに、従来の据置型の機器では計測環境が限られるなどの課題があり、手首装着型の機器として小型化が必要となる。デバイスが大型化する要因として、複数の圧力センサを処理するために回路規模が大きくなる、センサの雑音耐性が低いために後段の回路で対策が必要となるために回路規模が大きくなるなどがあり、センサを含むシステム全体として解決する必要のある課題も抱えていた。
以上を踏まえ、新たな連続血圧計の開発に際しては、センサに関わる前述の課題を解決するため、大別して以下二つの開発が必要となる。
ⅰ.良好なセンサ特性と雑音耐性を有し、実装歩留まり改善可能なマルチエレメントMEMS圧力センサの開発。
ⅱ.上記マルチエレメントMEMS圧力センサの表面に樹脂を塗布しても良好な特性を保持可能で、安定して生産可能な新たなセンサパッケージ構造と工法開発。
3. センサチップ開発と工法開発
3.1 センサチップ開発
前述した連続血圧計のための圧力センサの特性や実装歩留まりの課題を抜本的に改善すべく、図2に示す新たなマルチエレメントMEMS圧力センサを開発した(以下、センサチップと記載する)。開発したセンサチップの形状は長さ11.5 mm、幅3.0 mm、厚み400 µmであり、中心に長さ9.5 mm、幅0.26 mm、厚み5 µmのダイアフラムを形成し、ダイアフラム上にピエゾ抵抗を形成している。ダイアフラムが圧力を受けて変形すると、変形量に応じた応力が発生し、この応力によってピエゾ抵抗における導電率すなわち抵抗率が変化する。このピエゾ抵抗でブリッジ回路を形成することで、圧力に応じた抵抗変化を電圧で検出している。開発した圧力センサは、ダイアフラム上にピエゾ抵抗のブリッジ回路を46個、200 µmの狭ピッチで構成し、温度センサもセンサチップ上に複数形成した。温度センサをセンサチップ上に複数構成することで、周辺温度ではなくセンサチップの温度を直接計測可能であるため、圧力換算式の温度補正に使用することができる。さらに、開発したセンサチップはASIC(Application Specific Integrated Circuit)混載であり、マルチプレクサ、オペアンプ、フィルタ回路がセンサチップ上に実装されている。従来の周辺回路をセンサチップ内に全て混載することで、以下のような利点がある。
- マルチプレクサの混載により電極数を削減でき、後工程の生産難易度を下げ、実装歩留まりを向上できる。
- オペアンプの混載により、各圧力センサエレメントの出力を短い配線長で増幅およびインピーダンス変換可能であり、雑音耐性が向上する。
- 後段での回路規模を縮小することが可能であり、システム全体の小型化を実現できる。
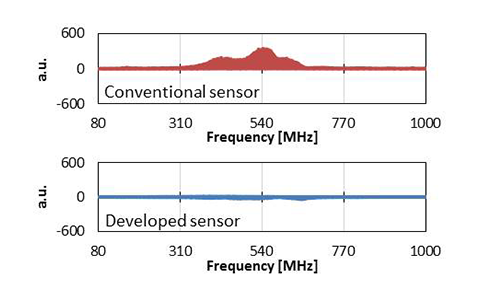
表2に従来センサと新センサの電極数の比較を示す。表2の従来センサはトノメトリ法を利用したCAP/FAPセンサという圧脈波測定機器である。新センサは従来センサと比較して、圧力および温度センサエレメントの数は増えているが、電極数は1/3以下に削減できていることがわかる。また、オペアンプやフィルタ回路混載によって雑音耐性を向上させているが、実際には図2に示すセンサチップのダイアフラム部以外をメタルシールドしており、雑音耐性はさらに向上している。図3に従来および新センサ単体でのEMS(Electro-Magnetic Susceptibility)試験の結果を示す。試験は搬送波を80~1000 MHz、変調波2 Hz、電界強度3 V/mとした。図3の縦軸は電磁波照射の影響をどの程度受けているかを表しており、横軸は照射している搬送波の周波数である。新しいセンサでは、センサ単体での雑音耐性が改善していることがわかる。

| 機器 | エレメント数 | 電極数 |
|---|---|---|
| 従来センサ | 圧力 30ch+温度 4ch | 72 |
| 新センサ | 圧力 46ch+温度 2ch | 22 |
3.2 新パッケージ構造の提案
オシロメトリック法による血圧計測では、カフ内の圧力が空気を媒体として半導体の圧力センサに直接伝達されるが、トノメトリ法による連続血圧計測では圧力センサを皮膚に直接押圧する必要があることは前述の通りである。そのため、圧力センサを生体適合性の良い樹脂封止(以下、ポッティングと記載)する必要があるが、ポッティングする樹脂の弾性率が低すぎると変形量が大きくなり正しく圧力を伝達できないため、ある程度硬さのある樹脂を選択する必要がある。しかしながら、弾性率が高くなると、樹脂は硬化時にセンサチップに応力を残存させ、さらに樹脂は周辺温度の変化に伴い膨張収縮するために、圧力センサを樹脂でポッティングすると一般的には特性が著しく悪化してしまう。したがって、弾性率の高い樹脂でポッティングしたとしても特性を悪化させない、これまでにないパッケージ構造や工法を新たに開発する必要がある。特に、46個もの圧力センサ全てが、均一かつ圧力計測の精度を確保できるようにパッケージングすることが重要である。
また、センサチップから信号を引き出すために、種々の工法の中からワイヤ・ボンディングを選択する。ワイヤ・ボンディングは、チップサイズの小型化に伴う電極端子の狭ピッチ化にも対応してきた背景があり、また一般的に低コストで生産性が高い利点がある 8)。一方で、通常ワイヤ・ボンディングの場合には、ワイヤにストレスが加わらないようにパッケージングする必要があるが、前述したように連続血圧計測のために皮膚に直接押圧するため、ワイヤを保護するための樹脂も必要となる。纏めると、図4 (a)に示すように、ワイヤを保護するためのストレス強度の高い樹脂と、センサチップ全体を覆う生体適合性の良い樹脂でのポッティングが必要となる。すなわち異なる特性が要求される高弾性の樹脂を二重に塗布する必要がある。
前述したようにワイヤ保護樹脂は、ワイヤの断線を保護するために弾性率の高い樹脂を選定する必要がある。しかしながら、図4 (a)で示した構造では、ワイヤ保護樹脂がセンサチップの短辺方向への圧縮および引張応力を残存させ、46個の圧力センサの特性が不均一となる、また温度特性が著しく悪化することが事前評価で観測されている。したがって、ワイヤ保護樹脂から受ける応力を最小化するような新たな構造や工法、樹脂の選定が必要となる。筆者らは、図4 (b)に示すように、ワイヤ保護樹脂の量を削減し、センサチップがワイヤ保護樹脂から受ける応力を最小化するために、バスタブ状のセラミック基板にセンサチップをダイボンドする構造を考案した。セラミック基板がキャビティを有しており、このキャビティにセンサチップを固定し、セラミック基板とセンサチップの隙間を応力の影響が殆ど出ない低い弾性率の樹脂(以下、フィル樹脂と記載)で埋めることで、弾性率の高いワイヤ保護樹脂の量を最小化できる。さらに、センサチップの表面にのみワイヤ保護樹脂が塗布されているために、ワイヤ保護樹脂による残留応力が発生しにくいと考えられる。次節では、バスタブ形状基板の最適化について、その詳細を記述する。
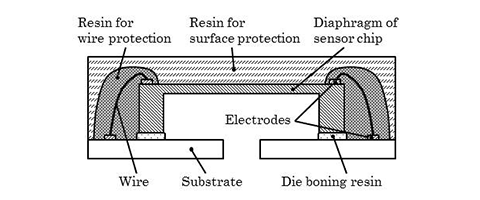
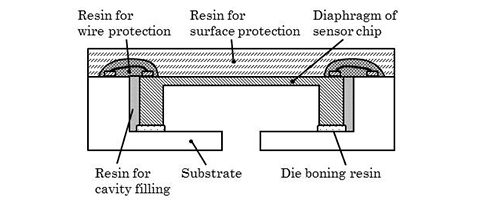
図4 パッケージ構造の新旧比較
3.3 応力シミュレーションによる構造最適化
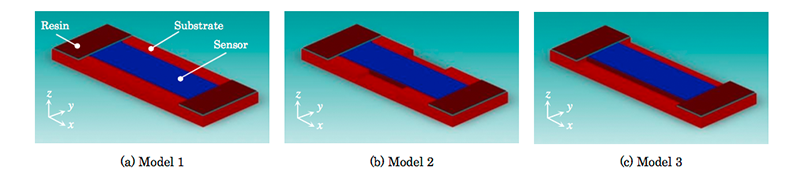
提案するバスタブ形状基板において、ワイヤ保護樹脂の膨張収縮による応力がセンサチップに最も影響を与えない形状を応力分布シミュレーションによって構造を最適化する。シミュレーションモデルは図5に示す3パターン用意した。Model 1は単純なバスタブ構造(図5 (a))で、Model 2はバスタブの中央部分を削除した構造(図5 (b))、Model 3はワイヤ保護樹脂部分のみバスタブ構造となっており中央部分は全く壁が無い構造(図5 (c))とした。センサチップはシリコン半導体としての物性値を用い、バスタブ基板はセラミックの物性値を用いた。また、ワイヤ保護樹脂は弾性率470 MPa、熱膨張係数51 ppm/℃とし、温度を50℃変化させた時センサチップにどのような応力分布が発生するかを解析した。
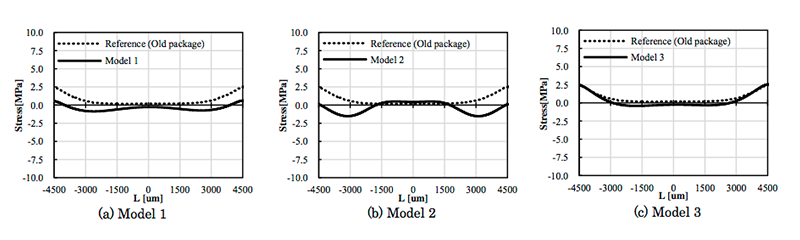
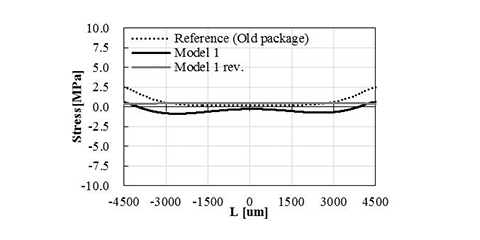
図6にModel 1~3のダイアフラム上に発生する応力分布のシミュレーション結果を示す。図6の横軸Lはダイアフラム中心からの距離であり、実際のセンサチップでは -4500 ~4500 µmまでに200 µmピッチで圧力センサが配置されている。図6の縦軸は、y軸方向への応力を示しており、正の値は圧縮応力、負の値は引張応力を意味する。また、図6の(a)、(b)、(c)にそれぞれModel 1~3の結果を示しているが、Reference (Old package)と記載してグラフ化しているのは、図5に示したシミュレーションモデルには記載がないが、図4 (a)に示した旧パッケージの応力分布シミュレーション結果であり、参考として併記した。Model 1は旧パッケージと比較して応力の平均値が0に近づいており、圧力センサエレメント間のばらつきが小さくなっている。Model 2はダイアフラムが受ける応力の平均値は0に近づいているが、圧力センサエレメント間でのばらつきは旧パッケージと同等である。また、Model 3は旧パッケージと同等の応力分布であり、構造変更による効果が殆ど現れていない。以上より、センサチップの周辺が全て壁で囲まれているバスタブ形状が、ワイヤ保護樹脂による応力の影響を受けにくい構造であり、センサ特性を悪化させず各圧力センサエレメントの特性を均一に保つことができる構造であると考えられる。さらに、詳細は省略するが、Model 1における構造に関する種々のパラメータを微調整することによって、図7に示すように応力分布をよりフラットに近づけることが可能となる。
3.4 ワイヤ保護樹脂の最適化
バスタブ形状のセラミック基板を用いて開発したセンサチップをパッケージングするが、前述してきたように数種類の樹脂を用途別に選定する必要がある。それぞれの樹脂について、名称と用途を表3に纏める。
| 名称 | 用途 |
|---|---|
| ダイボンド樹脂 | センサチップとセラミック基板を接着する |
| フィル樹脂 | センサチップとセラミック基板の隙間を埋め ワイヤ保護樹脂の侵入を防ぐ |
| ワイヤ保護樹脂 | ワイヤを保護する |
| 表面保護樹脂 | センサチップの保護および人体接触部の生体 適合性を担保し,圧力を伝達する |
ダイボンド樹脂とフィル樹脂については、その用途から残留応力の影響が出ないよう弾性率の低い樹脂を選定する必要があり、表面保護樹脂については生体適合性の良い樹脂で、動脈の圧脈波を十分に計測可能な機械的特性を有する樹脂を選定する必要があるが、本論文では詳細な選定過程については省略する。本論文では、ワイヤ保護樹脂の選定過程について以下記述する。ワイヤ保護樹脂は、ワイヤを保護するために弾性率の高い樹脂を選定したい一方で、センサチップへの残留応力をできる限り低減したいため弾性率の低い樹脂を選定したいというトレードオフがある。また、弾性率の高い樹脂でワイヤを覆うことで、温度による膨張収縮がセンサチップだけでなくワイヤに応力を印可し、ワイヤ断線を引き起こす可能性もあり、これらはシミュレーションだけでは結論を出すことが難しい。したがって、実際にバスタブ状セラミック基板に実装し、その実力値を確認する必要がある。
筆者らは、開発したバスタブ状セラミック基板へセンサチップを実装し、センサ特性(オフセット、圧力感度、リニアリティ、および各項目の温度特性)と実装歩留まりについて評価を実施した。ワイヤ保護樹脂の条件としては、エポキシ系の高弾性率の樹脂と、シリコーン系の低弾性率の樹脂の2パターンで評価サンプルの試作を行った。但し、シリコーン系樹脂はエポキシ系と比較すると低弾性率の樹脂であるが、ワイヤ保護の観点からシリコーン系の中では弾性率が高いものを選定した。センサ特性の詳細については本節では省略し、次章で最終品について記述するが、センサ特性としてはエポキシ系でもシリコーン系でも差は無く良好な特性で、圧力センサエレメント毎のばらつきも小さかった。しかしながら、エポキシ系のワイヤ保護樹脂で実装した試作サンプルは、53%(8/15)のサンプルで断線が確認された。一方で、シリコーン系のワイヤ保護樹脂では、断線したサンプルは確認されなかった。工程では、ワイヤ保護樹脂の塗布および硬化後、配線の引き出しのためにセラミック基板をFPC(Flexible printed circuits)基板にリフロー(260℃)で実装するが、リフローでエポキシ系樹脂の試作サンプルは断線を引き起こしていることがわかった。エポキシ系樹脂の温度変化による膨張収縮が、その高弾性率からワイヤに対し大きなせん断力を発生し、断線を引き起こしていた。一方で、ワイヤ保護樹脂としてシリコーン系を使用したサンプルでは、熱衝撃試験(-20℃、60℃を1サイクル60分の5回繰り返し)や半田耐熱温度サイクル試験(ピーク温度260℃を3回繰り返し)を行っても断線は確認されず、実際の使用圧力以上の耐圧試験(500 mmHgを10回印可)においても断線は確認されなかった。したがって、選定したシリコーン系のワイヤ保護樹脂によって、ワイヤ断線等による実装歩留まり悪化などで生産性の低下を引き起こすことなく、さらに実使用条件でもワイヤを保護できる十分な強度を有していることが示された。
4. センサモジュールの特性評価
センサチップをバスタブ状のセラミック基板に実装し、表面保護樹脂を塗布して人体に直接接触できる状態となったものを本論文ではセンサモジュールと呼ぶ。開発したセンサモジュールとしての特性評価は、大別して以下の二つがある。
A)圧力温度特性
B)圧脈波計測特性
圧力温度特性は、センサモジュール表面(表面保護樹脂側)に温度条件を変更しながら圧力を印可する。圧脈波計測特性は、実際に人体にセンサモジュールを押圧して動脈内圧すなわち血圧波形を計測できるか否かを評価するが、我々は人体手首での経皮的血圧計測を模擬できるファントムを開発し、これを用いて評価を行った。
4.1 圧力温度特性の評価
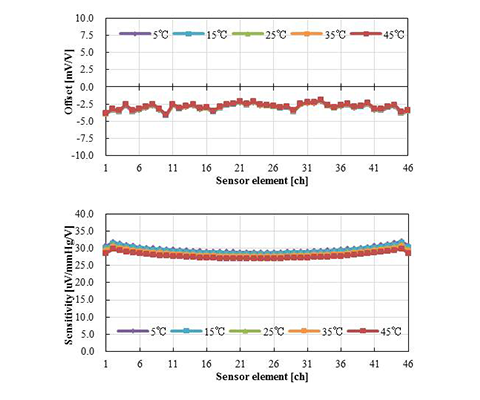
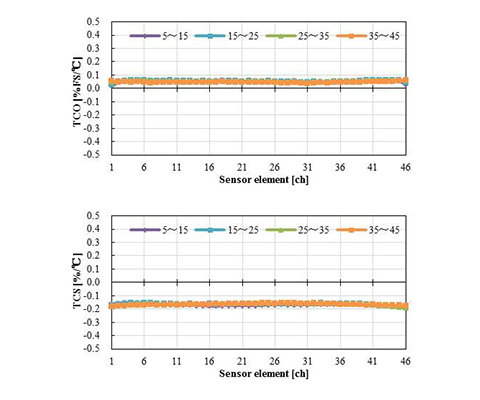
温度条件5、15、25、35、45℃で圧力を印可した時の、オフセット、センサ感度特性の代表値を図8に示す。オフセットとは大気解放時のセンサ出力を意味し、センサ感度は300 mmHg印可のセンサ出力を用いて計算しており、共にセンサチップの入力換算値である。また、図8の結果をオフセットの温度係数(TCO:Temperature coefficient of offset)およびセンサ感度の温度係数(TCS:Temperature coefficient of sensitivity)として換算した結果を図9に示す。TCOおよびTCSは、各温度の特性差が判別できるよう、5~15℃、15~25℃、25~35℃、35~45℃でそれぞれ算出している。図8および図9における横軸は、圧力センサエレメントの番号を表している。
センサチップの設計仕様は、オフセットについてはtyp.-2.5 mV/V(-7.5~2.5 mV/V)、センサ感度についてはtyp.31 µV/mmHg/V(23.2~38.8 µV/mmHg/V)であるが、図8の結果から、全ての圧力センサエレメントが仕様範囲内であることがわかる。また、オフセットおよびセンサ感度ともに温度によって特性が著しく変化していないこともわかる。一方で、図8ではオフセットおよびセンサ感度共に、中央から端の圧力センサエレメントにかけて緩やかに特性が変化しているように見えるが、これは周辺樹脂の影響ではなく、センサチップのダイアフラム形状に依存する特性であり、実装前のセンサチップ単体での特性評価においても同様の傾向となるため、実装によって特性が悪化しているものではない。さらに、図9からTCOは約0.05%FS/℃、TCSは約0.2%/℃で圧力センサエレメント毎に差が無く均一な特性となっている。これは、オフセットおよびセンサ感度の温度による影響が、各圧力センサエレメントで、あるいは低温側から高温側までの各温度において、温度係数が小さいかつ均一な特性であることを意味する。 また、TCOとTCSのセンサチップの設計仕様はそれぞれ、typ.0.036%FS/℃(-0.034~0.107%FS/℃)およびtyp.-0.203%/℃(-0.353~-0.107%/℃)であり、設計仕様範囲内であることがわかる。実装による特性悪化の影響を受けているとすれば、パッケージングで使用する樹脂の中で最も弾性率が高いワイヤ保護樹脂の影響が温度特性として現れるはずである。また、ワイヤ保護樹脂はセンサチップの両端にのみ塗布しているため、両端の圧力センサエレメントでその影響が顕著になるはずであるが、図9の結果からその傾向は見受けられない。したがって、応力分布シミュレーションの結果を元に提案した新たなパッケージ構造および工法によって、圧力センサエレメント46個全ての特性を良好に保ったまま、センサ周辺に種々の樹脂を塗布できることが示された。
4.2 手首ファントムを用いた評価
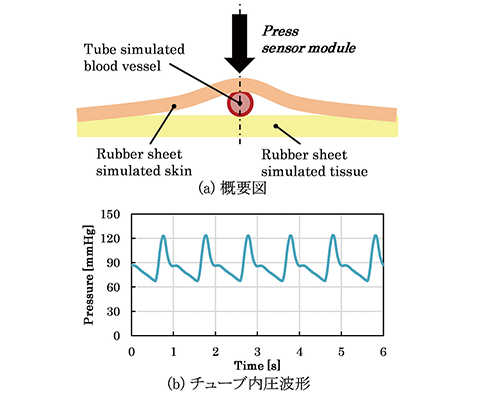
4.1節では、センサモジュールに圧力および温度を印可し、一般的な圧力センサとしての特性を評価したが、空気による圧力印可であること、また静的圧力であることから、人体に直接センサモジュールを押圧する状況とは異なる。そこで、我々は一般的な圧力センサとしての特性評価だけでなく、実条件に近く、さらに再現性の良い手首ファントムを開発し評価を実施した。開発した手首ファントムによるセンサ評価システムを図10に示す。手首ファントムは、図10 (a)に示すように、橈骨動脈を模擬する管、皮膚を模擬するゴムシート、組織を模擬するゴムシートで構成される。構成要素はそれぞれ、生体を機械的に模擬できる材料パラメータで予め選定されている。また、模擬血管内は水で満たされており、さらに図10 (b)に示すように人体の動脈の拍動を模擬した圧力が外部から印可されている。本ファントムに開発したセンサモジュールを押圧することで、人体手首の橈骨動脈上皮膚にセンサモジュールを押圧している状況を模擬することができる。さらに、人体と異なり模擬血管の内圧は変動なく常に一定のリズムで拍動し続けるため再現性の高い評価が可能であり、かつ内圧波形を容易に計測できるため、開発したセンサモジュールで計測した波形と内圧波形の比較が容易となっている。
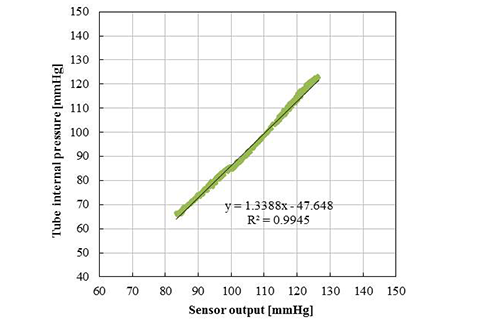
評価として、手首ファントムにセンサモジュールを一定の圧力で押圧した。この時の模擬血管の直上に位置する圧力センサエレメントの出力と、模擬血管内の圧力の関係を図11に示す。図11より、トノメトリ法に従って決定する最適な押圧状態においては、開発したセンサモジュールによって計測される波形と、模擬血管内の圧力波形が高い決定係数で相関することが示された。開発したセンサチップおよびセンサモジュールが、圧力センサとしての静的な圧力温度特性が良好であると共に、人体に直接押圧し経皮的に圧脈波を計測する用途において、動脈内の血圧波形を高い精度で再現できることを意味している。
5. 連続血圧計測への応用
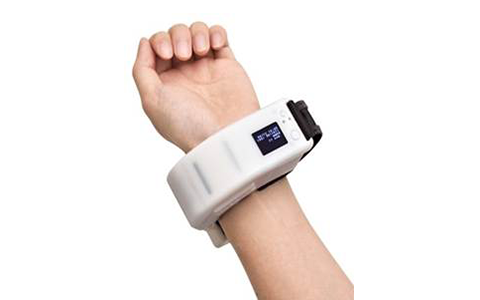
オムロン ヘルスケア株式会社では、2016年4月18日に手首だけで一拍毎の血圧値を連続で測定する技術を開発したとプレスリリースした5)。本技術で開発した連続血圧計プロトタイプは図12に示すデバイスであり、本技術に本論文で述べてきたセンサモジュールの試作サンプルが搭載されている。開発した新しいセンサチップおよびセンサモジュールを用いて、睡眠中の一拍毎の血圧波形を連続して計測する臨床研究がスタートしており、これまで計測できなかった全く新しい指標開発へ貢献している。例えば、夜間睡眠中に開発したセンサモジュールを皮膚に押圧し一拍毎の血圧を連続して計測することで、眠時無呼吸症候群による呼吸の停止が急激な血圧上昇を引き起こすことなどがわかっている 9)。序章でも述べた通り、過去にJENTOW6)と呼ばれる連続血圧計測機器が開発され、非侵襲な連続血圧計測に関して研究が行われてきたが、機器が大型であるために計測環境が限られるといった課題や、またセンサモジュール作製に起因する生産工程における実装歩留まり悪化など課題があった。連続血圧計が小型化できたのは、ASIC混載によって周辺回路をセンサチップ内に取り込んだことによる後段回路の縮小、雑音耐性の向上によって後段での対策が不要となり回路規模が縮小できたことも、デバイスとして進化できた要因の一つとして貢献している。さらに、半導体センサのパッケージングにおいては実装コストが高くなるため、実装歩留まりが悪化すると、さらにコストが上昇しデバイスを広く提供するための障壁となり得る。その意味で、センサモジュールの特性や実装歩留まりを抜本的に改善できたことは、新たに開発するデバイスの低コスト化に貢献し、広くデバイスを普及し臨床研究を加速させることに繋がると考えられる。
6. 結論
トノメトリ法を利用した連続血圧計測では、圧力センサをアレイ上に配列した特殊なセンサが必要となる。従来のマルチエレメントMEMS圧力センサでは、信号引き出し用の電極が多く後工程の難易度が高く実装歩留まりが悪化する、雑音耐性に課題があり後段回路が大規模になることなどの課題があった。本課題に対し、新たに、ASIC混載のマルチエレメントMEMS圧力センサを開発し、上記課題を抜本的に改善することができた。また、一般的に圧力センサのパッケージングでは、樹脂など応力を発生し特性を悪化させるものは極力塗布しないように実装するが、トノメトリ法を利用した連続血圧計測では、圧力センサチップに樹脂を積極的に塗布する必要があった。そのため、樹脂塗布によるセンサ特性の悪化や実装歩留まりの悪化などが課題となっていた。そこで、 樹脂を塗布してもセンサ特性が悪化しない新しいパッケージ構造およびその工法を開発した。新しいパッケージ構造として、センサチップを平坦な基板に実装するのではなく、キャビティを有するバスタブ状のセラミック基板に実装することを提案した。新しいパッケージ構造の最適化のため、応力分布シミュレーションを駆使し、短時間かつ低コストで最適な構造を導き出した。応力分布シミュレーションで導き出した構造でサンプルを作製し、ワイヤ保護樹脂や本論文では詳細は省略したその他樹脂の選定を実施し、パッケージとして実装したセンサモジュールとしての圧力温度特性を46個全ての圧力センサエレメントで良好に保つことに成功した。さらに、圧力センサとしての静的な特性だけでなく、トノメトリ法による連続血圧計測における特有の条件である皮膚に直接センサを押圧するという状況で評価するために、手首ファントムの開発も行った。実際に、手首に走行する橈骨動脈上の皮膚から圧力センサを押圧するのと同等のファントムを構築することで、常に変化する人体とは異なり、再現性の良い環境下でセンサモジュールとしての評価を実施した。その結果、開発したセンサモジュールは、トノメトリ法で血圧波形を計測する用途において、良好な特性を示すことが確認できた。現在は、開発したセンサモジュールを安定して生産できるよう量産に向けた工法開発を進めており、引き続きデバイスと共に開発・評価を進める計画である。開発したセンサモジュールを連続血圧計のコア部分として組み込み、オムロン ヘルスケアの新たなミッション「脳・心血管疾患の発症ゼロ」に向け挑戦を続ける。
参考文献
- 1)
- H. Kubota. "History of blood pressure", The Japanese journal of medical instrumentation, Vol. 80, No. 6, pp. 615-621, 2010.
- 2)
- O. Shirasaki. "Roles and advancements of blood pressure monitors in cardiovascular medicine", The Japanese Journal of Medical Instrumentation, Vol. 80, No. 6, pp. 622-631, 2010.
- 3)
- 今井 潤, 大久保 孝義, 菊谷 晶浩, 橋本 潤一郎. "家庭血圧の臨床応用", 日本内科学会雑誌, Vol. 93, No. 9, pp. 202-209, 2004.
- 4)
- E. Rapsomaniki, A. Timmis, J. George, M. Rodriguez, A. Shah, S. Denaxas, I. White, M. Cauleld, J. Deaneld, L. Smeeth, B. Williams, A. Hingorani, H. Hemingway. "Blood Pressure and Incidence of Twelve Cardiovascular Diseases: Lifetime Risks, Healthy Life-Years Lost, and Age-Specific Associations in 125 Million People", Lancet, Vol. 383, No. 9932, pp. 1899-1911, 2014.
- 5)
- オムロン ヘルスケア株式会社. "世界初 手首だけで1拍ごとの血圧値を連続で測定する技術を開発", https://www.-healthcare.omron.co.jp/corp/news/2016/0418.html. (参照2018年2月19日)
- 6)
- T. Sato, M. Nishinaga, A. Kawamoto, T. Ozawa, H. Takatsuji. "Accuracy of a continuous blood pressure monitor based on arterial tonometry", Hypertension, Vol. 21, No. 6, pp. 866-874, 1993.
- 7)
- 東健彦, 岡小天. "もっとも一般的な血管壁張力理論", 脈管学, 講談社, pp. 390-392, 1982, 東京.
- 8)
- 春田 亮. "リードフレームを使用した半導体パッケージ". 表面技術, Vol. 60, No. 4, pp. 225-231, 2009.
- 9)
- K. Kario. "Evidence and Perspectives on the 24-hour Management of Hypertension: Hemodynamic Biomarker -Initiated 'Anticipation Medicine' for Zero Cardiovascular Event", Progress in Cardiovascular Diseases, Vol. 59, No. 3, pp. 262-281, 2016.
















